Começa aqui mais uma etapa de como a humanidade alterou sua compreensão do aspecto microscópico do universo.
CONTEXTO HISTÓRICO
Cerca de nove décadas se passaram desde o modelo anterior (link), proposto por Dalton. Quem olha rapidamente para este cenário pensa que muito tempo se passou para o "pouco" acrescentado. Mas aí é que está o detalhe. Nesse mesmo período houve um grande desenvolvimento tecnológico e científico em várias áreas. Homens como Faraday, Maxwell e Ampère, não necessariamente nesta ordem, ajudaram a desenvolver a física do eletromagnetismo. Desenvolvimento este tão bem aproveitado por Tesla e Thomas Edison, dois inventores que foram capazes de levar a simples ideia da eletricidade à invenção das lâmpadas, dos geradores e da iluminação pública.
A partir disso, eletricidade e equipamentos eletrônicos se tornariam cada vez mais comuns, seja em ambientes domésticos ou laboratórios. É neste contexto que entra o tubo de raios catódicos, uma peça fundamental de aparelhos de televisão e monitores de tubo. Hoje artigos de museu. Mas no final do século XIX, tal dispositivo serviu para algo um pouco mais simples e não menos importante: a detecção de que o elétron é parte constituinte da matéria, sendo parte do átomo, portanto.
Descarga elétrica na atmosfera, ou um raio.
A eletricidade já era conhecida quando Thomson fez seus experimentos, mas não se sabia a relação entre ela e as partículas constituintes da matéria: os átomos.
PRECURSORES DE THOMSON
Eis que surge o tubo de raios catódicos e muda este paradigma. Mas para ocorrer esta mudança, pequenos detalhes se fizeram presentes. Por exemplo, no início do século XIX Michael Faraday fez um experimento com eletrodos nas extremidades de um tubo de vidro horizontal e conectados aos polos de uma bateria (ou pilha), como a inventada por Alexandre Volta.
Michael Faraday e um esquema de seu experimento.
Faraday observou que ocorriam dois brilhos distintos: um ao redor do polo negativo, chamado cátodo, e outro ao redor do polo positivo, chamado ânodo. Semelhante ao da foto abaixo.
Faraday também observou que, ao trocar o gás presente no interior do tubo, a cor do brilho ao redor do ânodo era também trocada, mas a do cátodo permanecia constante. A isso ele denominou brilho catódico. Mas nada soube dizer a respeito da natureza de tal brilho.
Em 1855, um físico e inventor alemão chamado Heinrich Geissler desenvolveu uma bomba de vácuo sem peças móveis e à base de mercúrio, o único metal líquido à temperatura e pressão ambientes. Com este equipamento, foi possível reduzir em mais de 99,99% a pressão do gás dentro de um tubo qualquer, exigindo assim, um vidro que suportasse a pressão externa a ele aplicada.
Heinrich Geissler e sua invenção.
Coube a Juliius Plücker, um amigo de Geissler, a ideia de inserir placas metálicas dentro do tubo e conectá-las a uma bateria. Acompanhado de seu aluno, Johann Hittorf, Plücker observou uma coloração verde pálida brilhando no próprio tubo após este ser atravessado pelo corrente elétrica gerada.
Julius Plücker e sua adaptação ao tubo de Geissler.
O que Plücer e Hittorf observaram foi algo semelhante à foto abaixo.
Em 1975, William Crookes fez uma série de experimentos e contribuiu para uma melhor compreensão desse fenômeno. Em um deles um tubo de vidro curvado foi utilizado e o brilho observado por Plücker e Hittorf foi notado mais uma vez na parte curva do tubo. Algo estava tocando no vidro e causando a emissão de luz.
William Crookes, o tubo curvado e o brilho em sua parte inferior.
Em outro experimento, um obstáculo na forma de uma cruz de Malta foi posicionado na direção dos raios. Ao ligar o aparelho, notou-se a formação de uma sombra, demonstrando que se deslocam em linha reta, de forma semelhante à luz.
Eugen Goldstein denominou tais raios como "raios catódicos", por seu eletrodo de origem.
Eugen Goldstein
Façamos um resumo até aqui para avançar sem que você se confunda:
1) Faraday observou dois brilhos distintos quando submeteu gases contidos em ampolas (tubos) de vidro a diferenças de potencial, ou seja, ligou a uma bateria e eletrodos suas extremidades. Um dos brilhos na região ao redor do cátodo e outro na região do ânodo.
2) Plücker e Hittorf observaram um único brilho quando repetiram o experimento de Faraday com um gás mais rarefeito. O brilho era semelhante ao da região do cátodo quando fora observado por Faraday.
3) William Crookes verificou que os raios emitidos a partir do cátodo se deslocavam em linha reta.
De posse de todas essas informações, coube a William Crookes realizar mais experimentos e caracterizar os raios catódicos, chegando às seguintes conclusões:
a) Não importava o metal usado nos eletrodos, os mesmos raios catódicos surgiram com as mesmas propriedades.
b) Na presença de campos magnéticos, a trajetória dos raios catódicos é alterada.
c) Na ausências de campos magnéticos, os raios se deslocam em trajetória perpendicular à superfície de onde partiram.
d) Os raios catódicos são capazes de produzir reações químicas, alterando, por exemplo, a cor de certos sais de prata quando atingidos por eles.
Crookes também testou o efeito de campos elétricos sobre a direção dos raios, usando placas carregadas eletricamente posicionadas em paralelo à trajetória dos raios, mas não obteve resultados satisfatórios que indicassem interação entre os raios e um campo elétrico.
Tais observações fizeram dos raios catódicos uma verdadeira incógnita. Não eram luz, pois interagiam com campos magnéticos, mas eram incapazes de interagir com campos elétricos.
É neste momento da história que surge J.J. Thomson. Ele realizou uma série de experimentos semelhantes aos de Crookes, mas com uma diferença tecnológica considerável, bombas de vácuo mais eficientes à sua disposição. Versões melhoradas da bomba de Geissler, modificadas por Hermann Sprengel, em 1873, permitiram um vácuo cem vezes melhor que o obtido por Crookes e Plücker.
Hermann Sprengel
O MODELO ATÔMICO DE THOMSON
Dessa forma, Thomson obteve resultados semelhantes aos de Crookes, os mesmos raios foram observados independente do resquício de gás existente dentro do tubo, independente do metal usado nos eletrodos e desviou quanto submetido a campos magnéticos. Além disso, dois outros experimentos foram realizados no sentido de caracterizar os raios catódicos.
Natureza corpuscular dos raios catódicos.
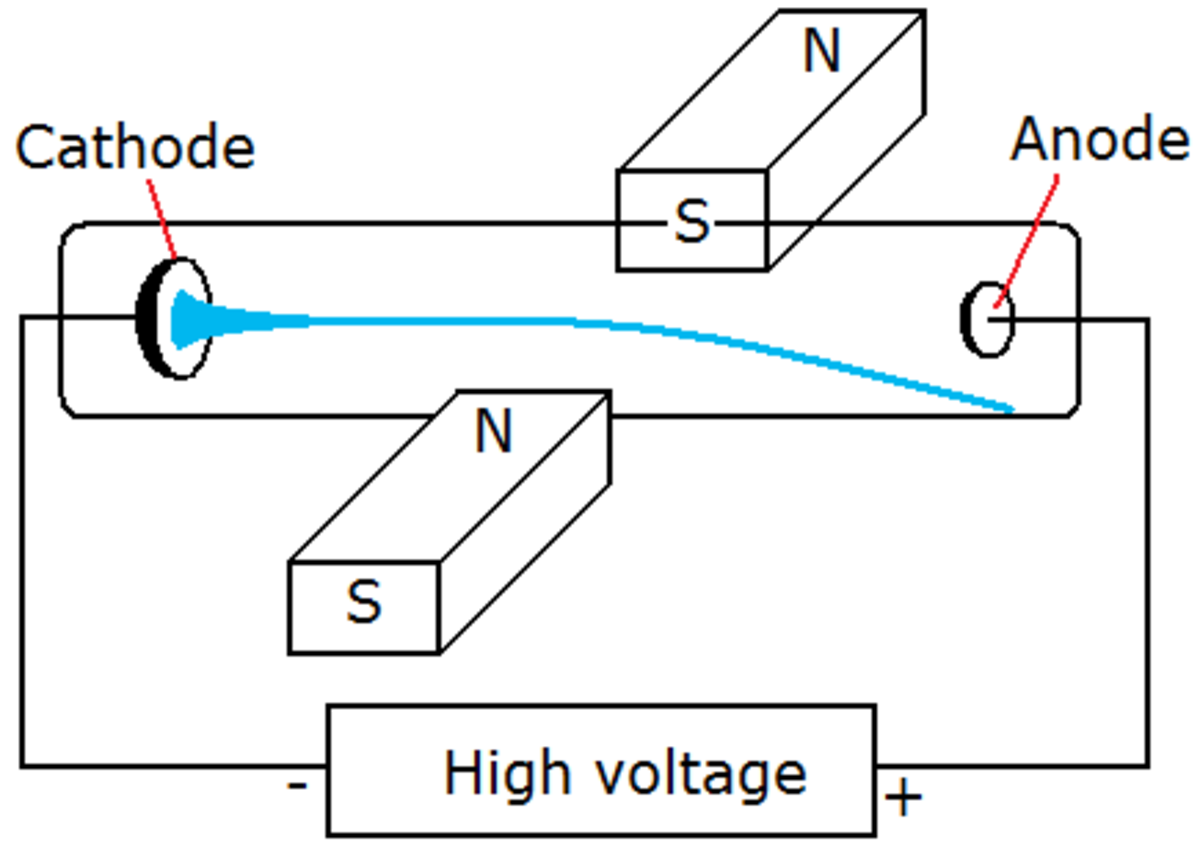
Representação esquemática do experimento de Thomson.
Um objeto devidamente posicionado começou a girar após ligarem o aparelho. Isto indica que algo dotado de massa estava colidindo com o objeto, restava detectar a natureza de sua carga.
Acima temos um equipamento semelhante ao usado por Thomson para determinar a natureza corpuscular dos raios catódicos.
Carga elétrica dos raios catódicos.
Observe em tracejado a trajetória que os raios catódicos deveriam seguir e uma linha contínua e inclinada indicando a trajetória que descreveram. Isto se deve ao fato de as placas defletoras estarem carregadas eletricamente.Em abril de 1897, Thomson tinha apenas indicações precoces de que os raios catódicos poderiam ser desviados eletricamente. Um mês após o anúncio do corpúsculo, ele descobriu que poderia desviar os raios de maneira confiável por um campo elétrico se evacuasse o tubo de descarga para uma pressão muito baixa. Ao comparar a deflexão de um feixe de raios catódicos por campos elétricos e magnéticos, ele obteve medições mais robustas da relação massa/carga que confirmou suas estimativas anteriores.
Thomson acreditava que os corpúsculos emergiam dos átomos do gás vestigial dentro de seus tubos de raios catódicos. Concluiu, assim, que os átomos eram divisíveis e que os corpúsculos eram seus blocos de construção.
Do grego, elektron significa âmbar.
Concluímos, desta maneira, que os raios catódicos são partículas (possuem massa) e são dotados de carga elétrica negativa. Foram batizados de elétrons, nome no grego antigo do âmbar, uma resina capaz de eletrizar após atritada com outros materiais.
Pena sendo atraída pelo âmbar após atrito.
As experiências de Thomson podem ser consideradas o início do entendimento da estrutura atômica. Suas experiências com o tubo de raios catódicos permitiram concluir irrefutavelmente a existência dos elétrons. Thomson acrescenta, então, "apenas" os elétrons ao modelo de Dalton, deixando o restante inalterado. Sendo assim conhecido popularmente por "pudim de passas".
O modelo do “pudim de passas”.
Em 1904, ele sugeriu um modelo do átomo, hipotetizando que era uma esfera de matéria positiva dentro da qual as forças eletrostáticas determinam o posicionamento dos corpúsculos. A publicação na qual ele publicou sua sugestão de modelo é chamada “Eletricity and Matter” (Eletricidade e Matéria).
“Eletricity and Matter” (Eletricidade e Matéria).
Todo cuidado com analogias nesta etapa é fundamental, o nome do modelo diz respeito à distribuição dos elétrons (passas), de carga negativa, por uma massa positiva, uniforme na distribuição da massa e da carga elétrica positiva. Isto contrabalanceia as cargas negativas provenientes dos elétrons, tornando o átomo neutro. Segundo Thomson, o número de elétrons que contém o átomo deve ser suficiente para anular a carga positiva da massa. Se um átomo perdesse um elétron, carregaria positivamente, pois teria uma carga positiva a mais em sua estrutura com relação ao número de elétrons, transformando-se em íons.
O pudim de passas e o panetone.
O termo “pudim de passas” não significa coisa alguma quanto a sua forma ou composição. Há até quem faça analogia com o panetone, mas é apenas quanto à distribuição dos elétrons em seu interior e superfície. Nada além disto! O átomo, na concepção de Thomson e seu contemporâneos continua com forma esférica. E com o iminente desenvolvimento de novas tecnologias e descobertas surpreendentes em outros ramos, o átomo assombrou a humanidade (ou os cientistas) quando se apresentou de fato.
QUEM FOI THOMSON?
Joseph John Thomson, mais conhecido como J. J. Thomson, foi um físico britânico vencedor do Nobel de Física, creditado com a descoberta e identificação do elétron, a primeira partícula subatômica a ser descrita. Thomson recebeu o Prêmio Nobel de Física de 1906 por seu trabalho na condução de eletricidade em gases.
Joseph John Thomson
Thomson também é reconhecido por encontrar a primeira evidência de isótopos de um elemento estável (não radioativo) em 1913.
CRÍTICAS AO MODELO DE THOMSON
O grande avanço de Thomson em relação a Dalton é a capacidade de seu modelo explicar fenômenos envolvendo a eletricidade. Como soluções aquosas de cloreto de sódio ou de ácido clorídrico conduzindo eletricidade.
Ainda nãos e sabia explicar em detalhes como os metais conduzem eletricidade, mas o fato de os elétrons pertencerem ao átomo apontou uma direção. Restava ainda explicar como o elétron se comportaria dentro do próprio átomo. Pois é inconcebível a ideia de que ele permaneceria em repouso.
A proposta de Thomson era a de que os elétrons realizariam um movimento harmônico simples (MHS) em torno do eixo central do átomo. No MHS, o elétron oscila em movimento retilíneo entre duas extremidades. Se o elétron estiver na superfície e na região equatorial do átomo, o raio deste MHS será o raio atômico. Caso o elétron esteja sobre outra região da superfície atômica ou no interior dele, então o raio de oscilação será menor que o raio atômico.
Elétron em MHS em torno do eixo que passa pelo centro da esfera atômica.
E como o elétron se desloca dentro do átomo se ele se encontra envolvido por uma massa homogênea? Eis a pergunta, não se fazia ideia. Como o elétron não pode permanecer parado em relação ao centro geométrico do átomo, de alguma forma ele deveria ser deslocar. Fornecendo indícios de que esta massa é viscosa como mel e não rígida como um metal.
E como eles tinham a certeza de que o elétron se movimenta dentro do átomo? Por questões já conhecidas do eletromagnetismo descobertas como a explicação do efeito fotoelétrico, um ano após a publicação do trabalho do próprio Thomson.
Tal compreensão de que o átomo deveria ser viscoso como o mel atiçou trabalhos de um ex-aluno de Thomson, mas isto é o próximo modelo (link).
MAPA MENTAL
Esta postagem te ajudou? Ficou alguma dúvida? Comenta aí...























Nenhum comentário:
Postar um comentário
Devido a brincadeiras de mal gosto e comentários trolls, os comentários serão moderados a partir de agora. Agradeço a compreensão.